昆明植物研究所在調控溶酶體穩態研究中取得新進展
溶酶體是細胞內的單層膜囊泡狀細胞器,包含數十種酸性水解酶,被認為是細胞的降解中心。近年來研究表明溶酶體是關鍵細胞活動和信號轉導的樞紐。溶酶體的穩態失衡介導了諸如退行性疾病、溶酶體貯積癥、惡性腫瘤等疾病的發生發展,也是針對重大疾病開發新治療策略的關鍵切入點。
中國科學院昆明植物研究所植物化學與天然藥物全國重點實驗室郝小江研究員團隊長期以來以活性天然小分子為探針,從化學生物學的角度探索生命關鍵過程及細胞器穩態的調控機制,相繼揭示了溶酶體生物發生、線粒體融合等細胞生物學過程的新穎調控機制,發現PKCa/d、AXIN、MFN1、CARF等蛋白的新功能(Nat Cell Biol. 2016; Nat Chem Biol. 2013,2023; Cell Discov. 2017),為神經退行性疾病、腫瘤等疾病的藥物發現和治療提供了新策略和潛在先導分子。
溶酶體在自噬過程中扮演著不可或缺的關鍵角色。自噬不但是一種細胞的保護性防御機制,同時也在介導細胞死亡方面發揮關鍵作用。團隊前期發現菲類化合物Trigonochinene E (TE)可以通過溫和的內質網應激途徑激活TFEB/TFE3依賴的溶酶體生物發生,促進細胞保護性自噬,緩解椎間盤髓核細胞退行性病變(Phytomedicine. 2023)。近期的研究發現從Walsura yunnanensis中分離得到的四降三萜類化合物isowalsuranolide (Hdy-7)可以通過直接靶向抑制硫氧還蛋白還原酶(TrxR1/2)并抑制其活性,導致活性氧(ROS)的積累,從而激活p53信號通路,通過其下游SESN2-mTOR通路觸發了TFEB/TFE3依賴的溶酶體生物發生及自噬。Hdy-7誘導的細胞自噬是一種過度的致死性自噬,并且紫杉醇耐藥的腫瘤細胞對Hdy-7誘導的細胞死亡仍然敏感。該研究揭示了TrxR1/2調控轉錄因子TFEB/TFE3的新機制,并為耐藥腫瘤治療提供了潛在的精準靶點與前沿策略。

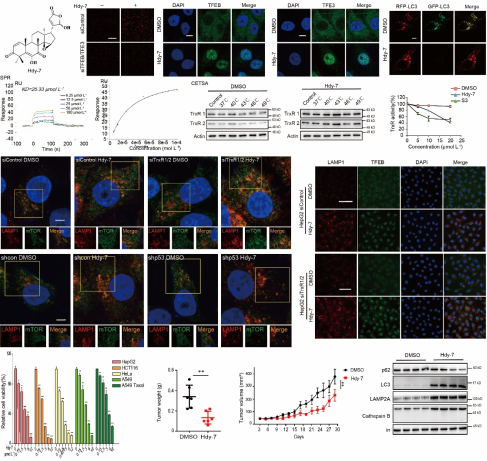
圖1 Hdy-7誘導溶酶體生物發生及致死性自噬
研究成果以Isowalsuranolide targets TrxR1/2 and triggers lysosomal biogenesis and autophagy via the p53-TFEB/TFE3 axis為題在Science China Life Sciences期刊上在線發表。中國科學院昆明植物研究所已畢業博士研究生楊旭、丁驍副研究員為該文共同第一作者,郝小江研究員、丁驍副研究員、趙逾涵研究員為共同通訊作者。該研究得到國家自然科學基金、中國醫學科學院創新單元、中國科學院“西部之光”、云南省“興滇英才支持計劃”等多項基金資助。
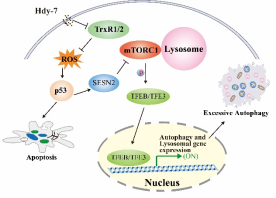
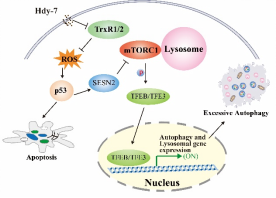
圖2. Hdy-7作用機制示意圖

| 我也說兩句 |
| 版權聲明: 1.依據《服務條款》,本網頁發布的原創作品,版權歸發布者(即注冊用戶)所有;本網頁發布的轉載作品,由發布者按照互聯網精神進行分享,遵守相關法律法規,無商業獲利行為,無版權糾紛。 2.本網頁是第三方信息存儲空間,阿酷公司是網絡服務提供者,服務對象為注冊用戶。該項服務免費,阿酷公司不向注冊用戶收取任何費用。 名稱:阿酷(北京)科技發展有限公司 聯系人:李女士,QQ468780427 網絡地址:www.arkoo.com 3.本網頁參與各方的所有行為,完全遵守《信息網絡傳播權保護條例》。如有侵權行為,請權利人通知阿酷公司,阿酷公司將根據本條例第二十二條規定刪除侵權作品。 |
 m.quanpro.cn
m.quanpro.cn