陳薇院士:謹慎解讀
新冠疫情仍在全球蔓延,針對性疫苗可能是這場全球大流行的“終結者”。根據世界衛生組織(WHO)的統計,全球有超過120個疫苗開發項目,其中已經有8個項目進入臨床試驗階段。
其中,由軍事科學院軍事醫學研究院生物工程研究所陳薇院士團隊和中國康希諾(CanSino)公司聯合開發的腺病毒5型(Ad5)載體疫苗是最早進入臨床試驗的候選疫苗之一。當地時間5月22日晚間,頂級醫學期刊《柳葉刀》(The Lancet)刊發一篇論文,題為“重組腺病毒5型載體COVID-19疫苗的安全性,耐受性和免疫原性:劑量遞增,開放標簽,非隨機,首次人類試驗”。陳薇等研究人員報告了在中國健康成年人中使用的Ad5載體COVID-19疫苗在接種后28天內的1期臨床數據,初步評估疫苗的安全性、耐受性和免疫原性。

這篇論文的通訊作者為陳薇院士及華中科技大學同濟醫學院附屬同濟醫院院長王偉教授、江蘇省疾病預防控制中心副主任朱鳳才。
陳薇表示,“這些結果是一個重要的里程碑。試驗表明,單次接種復制缺陷型人腺病毒5型(Ad5)載體新冠疫苗在14天內就能誘導產生病毒特異性抗體和T細胞應答,這使其成為具有潛力的可以進行下一步研究的候選疫苗。不過,我們對這些結果應謹慎解讀。研發COVID-19疫苗的挑戰是前所未有的,誘導免疫應答的能力并不一定表明該疫苗能完全保護人類免受SARS-CoV-2的感染。這些結果為新冠疫苗研發提供了積極前景,但距離該疫苗上市,我們還有很多工作要做。”
研究團隊在討論環節指出,總體來看,該候選疫苗能夠迅速激發人體的抗體和細胞免疫應答。不過目前針對COVID-19的保護相關尚不清楚,特異性抗體或T細胞在建立有效保護方面的作用尚未確定。因此,在這項研究中,研究團隊無法根據疫苗誘導的免疫反應來預測Ad5載體COVID-19疫苗的保護作用。
為加快對這一候選疫苗的臨床評估過程,研究團隊根據1期接種后7天和14天的數據,已經啟動2期臨床試驗,選用低劑量和中劑量進行進一步評估。
108名參與者接受低中高三組劑量注射
論文指出,這次評估的Ad5載體COVID-19疫苗是第一個在人體上進行試驗的新冠疫苗。Ad5載體COVID-19疫苗由陳薇團隊和康希諾公司聯合開發,該疫苗是一種表達SARS-CoV-2 刺突糖蛋白(S蛋白)的復制缺陷Ad5載體疫苗。
該疫苗使用一種減毒的普通感冒病毒(腺病毒,易感染人類細胞,但不致病)將編碼SARS-CoV-2 刺突(S)蛋白的遺傳物質傳遞給細胞。隨后這些細胞會產生S蛋白,并到達淋巴結,免疫系統產生抗體,識別S蛋白并擊退冠狀病毒。
Ad5載體COVID-19疫苗為液體劑型,每一瓶為0.5毫升,含5×10^10個病毒顆粒。臨床試驗是單中心、開放標簽、非隨機、劑量遞增的,在湖北武漢的一家康復中心對進行。參與者為年齡在18歲到60歲的健康成年人,沒有被SARS-CoV-2感染過。
參與者肌內注射單劑量候選疫苗:第一批參與者接受低劑量,隨訪至少3天后進一步讓第二批參與者接受中間劑量,然后經過安全觀察3天,最后一組參與者接受高劑量。
低劑量組參與者手臂肌肉注射1針,注射Ad5載體COVID-19疫苗1小瓶(5×10^10個病毒顆粒)。中等劑量組也是注射一針,但取2瓶Ad5載體COVID-19疫苗(1×10^11個病毒顆粒)。高劑量組采用雙針方案,一只手臂注射1瓶Ad5載體COVID-19疫苗,另一只手臂注射2瓶Ad5載體COVID-19疫苗(1.5×10^11病毒顆粒)。
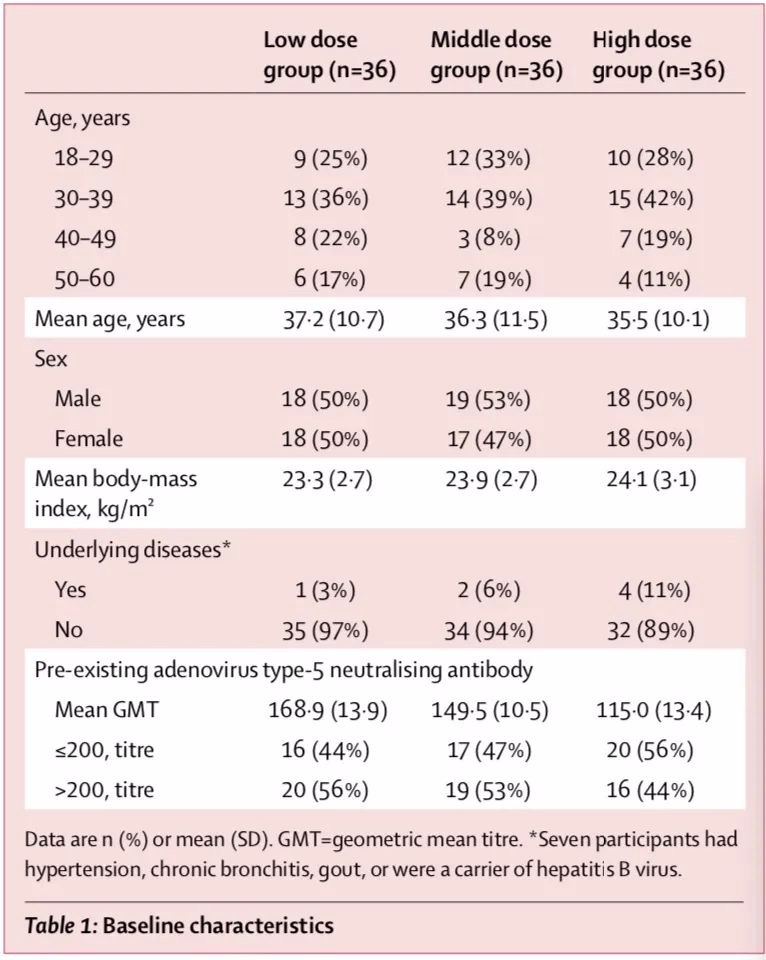
在2020年3月16日至3月27日期間,研究篩選了195名符合資格的志愿者。他們中的108人最終被安排接受低劑量(n=36[33%])、中劑量(n=36[33%])或高劑量(n=36[33%])。所有參與者在28天內完成疫苗接種和計劃隨訪。不同接種組參與者的基線特征相似。
28天內無嚴重不良事件報告
論文細節顯示,在接種后的7天內,87人(81%)報告了至少一個不良反應,低劑量組中30(83%), 中劑量組中30例(83%),高劑量組中27例(75%)(表2)。三組總不良反應數無顯著差異。
最常見的注射部位不良反應是疼痛,有58例(54%)疫苗接種者報告注射部位疼痛,低劑量組17人(47%)、中劑量組20人(56%)、高劑量組21人(58%)。
最常見的全身系統不良反應是發熱(50[46%])、疲勞(47[44%])、頭痛(42[39%])和肌肉疼痛(18[17%])。低劑量組有15人(42%)出現發熱、14人(39%)出現頭痛、7人(19%)肌肉疼痛;中劑量組有15人(42%)出現發熱、11人(31%)出現頭痛、3人(8%)肌肉疼痛;高劑量組有20人(56%)出現發熱、17人(47%)出現頭痛、8人(22%)肌肉疼痛。
多數不良反應為輕度或中度。9例(低劑量組2例[6%]、中劑量組2例[6%]、高劑量組5例[14%])出現高熱(3級),腋窩溫度高于38.5℃。其中,高劑量組有1人(3%)出現高熱的同時,伴有嚴重的疲勞、呼吸困難和肌肉疼痛癥狀。高劑量組的1例報告嚴重的疲勞和關節疼痛。
這些反應發生在接種后24小時內,持續不超過48小時。研究團隊在各劑量組之間沒有發現整體不良反應或不良事件發生率有顯著差異。研究提到,較高的預先存在的Ad5免疫力與接種疫苗后出現發熱顯著減少相關。
總體來說,28天內無嚴重不良事件報告。在接種疫苗后的第7天,9名(8%)受試者的總膽紅素輕度至中度升高,10名(9%)受試者的丙氨酸轉氨酶升高,4名(4%)受試者空腹高血糖,但這些均被認為無臨床意義。

參與者體內既有的Ad5的中和抗體削弱抗體免疫應答和T細胞免疫應答
在接種疫苗14天后,研究團隊觀察到與S蛋白受體結合域(RBD)相結合的抗體水平升高。在接種后28天,根據ELISA檢測,高劑量組的平均抗體滴度為1445.8,中劑量組為806.0,低劑量組為615.8。
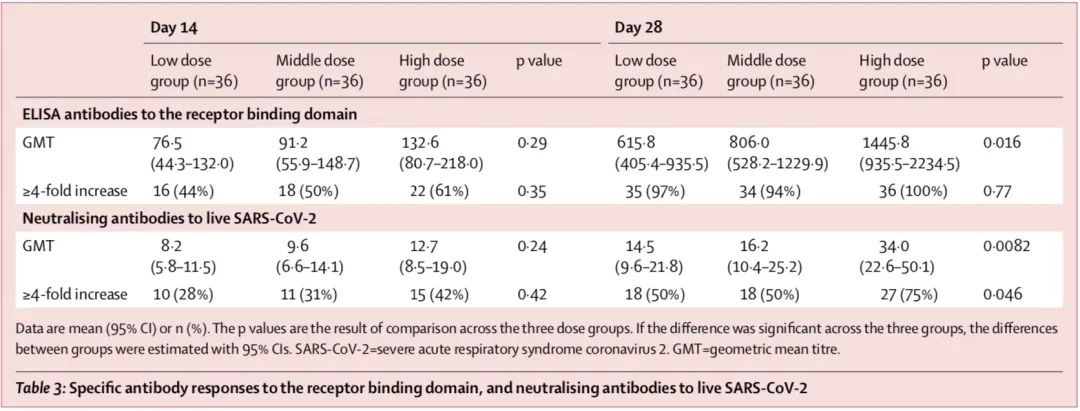
研究觀察到,與刺突蛋白RBD結合的抗體水平升高至少4倍的接種者人數分別為35(低劑量組,97%)、34(中劑量組,94%)、36(高劑量組,100%)人。針對活SARS-CoV-2的中和抗體在第0天均為陰性,在第14天適度增加,在接種后28天達到峰值。接種后第28天,高劑量組中和抗體滴度為34.0,顯著高于中劑量組(16.2)和低劑量組(14.5)。同時,在接種疫苗28天后,中和抗體水平至少提高4倍的參與者人數分別為18(低劑量組,50%),18(中劑量組,50%)、27(高劑量組,75%)。
值得注意的是,由于Ad5是一種普通感冒病毒,多數參與者體內已經產生對Ad5的中和抗體。具體來看,低劑量組的20名(56%)參與者、中劑量組的19名(53%)參與者和高劑量組的16名(44%)參與者均預先存在較高的Ad5中和抗體滴度(>1:2000)。這些預先存在較高Ad5中和抗體滴度的參與者中,低劑量組只有5名(25%)參與者、中間劑量組只有7名(37%)參與者、高劑量組只有10名(63%)參與者,在接種后第28天中和抗體滴定度至少提高4倍。
研究團隊分析認為,無論疫苗劑量如何,預先存在的高Ad5中和抗體滴度削弱了接種后中和抗體的血清轉換,而45-60歲的接種者中和抗體的血清轉換似乎低于較年輕的接種者。
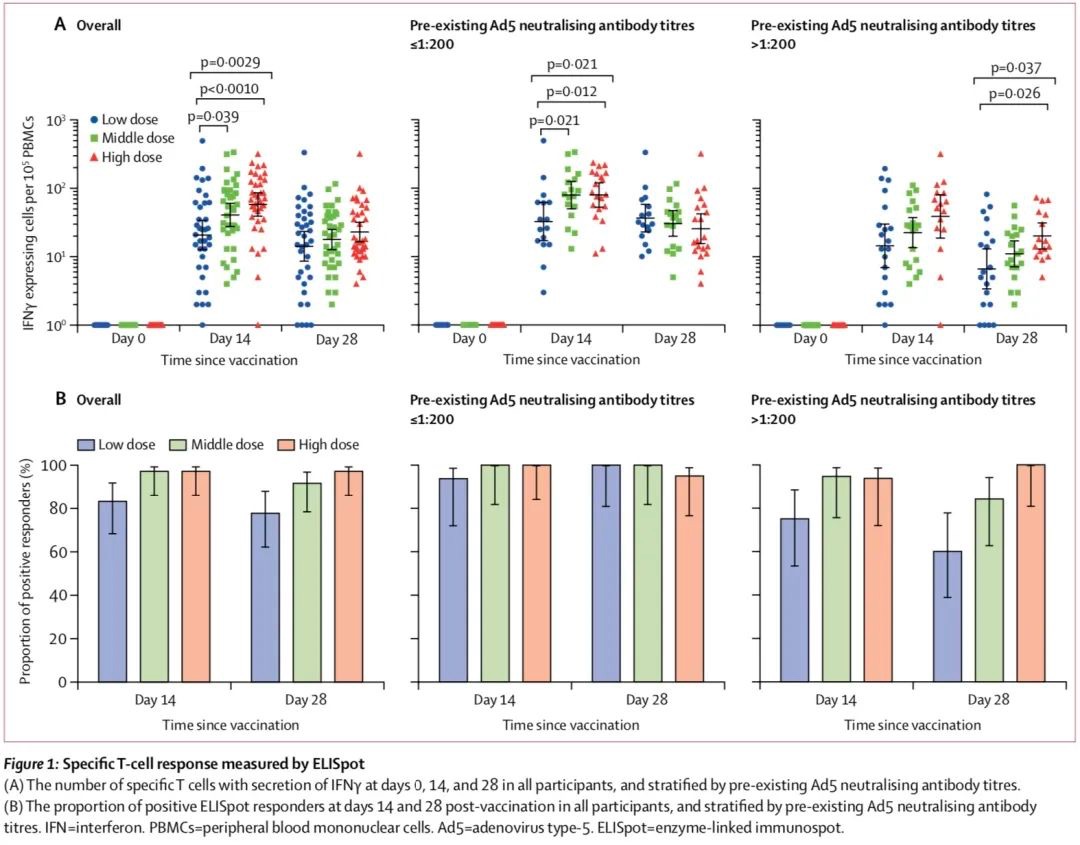
接種者的T細胞免疫應答則在接種后14天達到峰值。不同劑量組中產生T細胞免疫應答的人數比例在83-97%之間。高劑量組中產生T細胞免疫應答的人數顯著高于低劑量組,但與中劑量組比較差別不明顯。在接種后28天,各組T細胞免疫應答水平略有下降。
在所有劑量組中,高水平的基線Ad5中和抗體滴度降低了接種后T細胞反應的峰值,尤其是在低劑量組中。針對高預先存在的Ad5免疫的這部分參與者中,研究發現,在接種后第14天,各組產生T細胞免疫應答的人數分別為:低劑量組20人中的15人(75%)、中劑量組19人中的18人(95%)、高劑量組16人中的15人(94%)。在接種后第28天,各組產生T細胞免疫應答的人數分別為:低劑量組20人中的12人(60%)、中劑量組19人中的16人(84%)、高劑量組16人中的16人(100%)。

在接種后第14天和28天,研究團隊還檢測了各組CD4 +和CD8 + T細胞的IFNγ。接種后14天,低劑量組中CD4 + T細胞TNFα表達顯著低于高劑量組和中間劑量組;高劑量組CD8 + T細胞TNFα表達比中間劑量組和低劑量組更高。CD4+ T細胞檢測到的IL-2水平高于CD8+細胞。
為了排除研究期間任何可能的SARS-CoV-2暴露,研究團使用特異性IgG/IgM快速檢測試劑盒檢測了參與者在接種后第28天的SARS-CoV-2核衣殼蛋白的血清抗體,所有參與者均未呈陽性。
無法根據疫苗誘導的免疫反應來預測Ad5載體COVID-19疫苗的保護作用
研究表示,這是新型Ad5載體COVID-19疫苗的首次人體臨床試驗報告,試驗結果表明這款疫苗在3個劑量組的健康成年人中均表現出良好的耐受性,報告的不良反應多為暫時的輕、中度不良反應。其中,高劑量組的反應原性較高,表現為嚴重發熱、疲勞、肌肉疼痛或關節疼痛,可能與Ad5載體感染引起的病毒血癥有關。
他們認為,這款疫苗的安全性特征與陳薇團隊和康希諾公司此前基于同一平臺開發的埃博拉病毒疫苗相當。
為加快對這一候選疫苗的臨床評估過程,研究團隊根據1期接種后7天和14天的數據,已經啟動2期臨床試驗,選用低劑量和中劑量進行進一步評估。從目前數據來看,該候選疫苗能夠迅速激發人體的抗體和細胞免疫應答。不過論文指出,目前針對COVID-19的保護相關尚不清楚,特異性抗體或T細胞在建立有效保護方面的作用尚未確定。因此,在這項研究中,研究團隊無法根據疫苗誘導的免疫反應來預測Ad5載體COVID-19疫苗的保護作用。
然而,以往對SARS和 MERS的研究發現,特異性抗體的增加是暫時的,在患者康復后迅速下降,而特異性CD4+和CD8+ T細胞反應在免疫中發揮了重要作用。而COVID-19患者康復后特異性抗體數量也出現類似的快速下降,這表明特異性細胞免疫和體液免疫對COVID-19疫苗的成功都具有潛在的重要意義。
在這篇論文中,研究團隊只報告接種后28天內的數據,他們將對疫苗接種者進行至少6個月的隨訪,以獲得更多數據。論文同時指出,作為第一項評估Ad5-nCoV候選疫苗的臨床試驗,這一試驗設計評估的主要目標是評估候選疫苗在健康成年人中的安全性和耐受性,而不是衡量疫苗的有效性。
但研究團隊認為,根據目前的試驗結果,該疫苗值得在2期臨床試驗中接受進一步評估。值得注意的是,他們的研究結果表明,年齡較大可能對疫苗引發的對SARS-CoV-2的反應產生負面影響。在這項試驗中,沒有參與者年齡超過60歲,只有16%的參與者年齡超過50歲,這提供了有限的信息。
研究人員在2期臨床試驗中將納入年齡在60歲以上的志愿者,在這一新冠病毒感染高危人群中評估候選疫苗的安全性和效果。
| 我也說兩句 |
| 版權聲明: 1.依據《服務條款》,本網頁發布的原創作品,版權歸發布者(即注冊用戶)所有;本網頁發布的轉載作品,由發布者按照互聯網精神進行分享,遵守相關法律法規,無商業獲利行為,無版權糾紛。 2.本網頁是第三方信息存儲空間,阿酷公司是網絡服務提供者,服務對象為注冊用戶。該項服務免費,阿酷公司不向注冊用戶收取任何費用。 名稱:阿酷(北京)科技發展有限公司 聯系人:李女士,QQ468780427 網絡地址:www.arkoo.com 3.本網頁參與各方的所有行為,完全遵守《信息網絡傳播權保護條例》。如有侵權行為,請權利人通知阿酷公司,阿酷公司將根據本條例第二十二條規定刪除侵權作品。 |
 m.quanpro.cn
m.quanpro.cn